แบบจำลอง
แบบจำลองอะตอมของจอห์นดอลตันจอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมโดยอาศัยข้อมูลจากการทดลองที่พอจะศึกษาได้และนับว่าเป็นทฤษฎีแรกที่เกี่ยวกับอะตอมที่พอจะเชื่อถือได้ ซึ่งมีใจความดังนี้
สารทุกชนิดประกอบด้วยอนุภาคขนาดเล็กที่สุดเรียกว่า “ อะตอม”
อะตอมจะไม่สามารถแบ่งแยกได้ และไม่สามารถสร้างขึ้นใหม่ได้
อะตอมของธาตุชนิดเดียวกันจะมีสมบัติเหมือนกันทุกประการ
อะตอมของธาตุต่างกันจะมีสมบัติต่างกัน
ธาตุตั้งแต่สองชนิดขึ้นไปสามารถรวมตัวกันเกิดเป็นสารประกอบ โดยมีอัตราส่วนการรวมตัวเป็นตัวเลขอย่างง่าย เช่น CO CO 2
จากทฤษฎีอะตอมของดาลตัน แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของดอลตัน
( ตามทฤษฎีอะตอมของดอลตัน อะตอมในแนวคิดปัจจุบัน ข้อ 1, 3, 4 ใช้ไม่ได้ในปัจจุบัน)ข้อ 1. อะตอมไม่ใช่สิ่งที่เล็กที่สุด อะตอมยังประกอบด้วยอนุภาคอิเล็กตรอน, โปรตอน, นิวตรอน เป็นต้น
ข้อ 3 - 4 อะตอมของธาตุชนิดเดียวกันมีคุณสมบัติทางกายภาพไม่เหมือนกัน กล่าวคือมีมวลไม่เท่ากัน ซึ่งจะได้กล่าวต่อไป ในเรื่อง " ไอโซโทรป"
แบบจำลองอะตอมของทอมสัน
ทอมสัน ค้นพบ อิเล็กตรอน
การทดลองของรอเบิร์ด แอนดรูส์ มิลลิแกน ได้ผลการทดลองว่า อิเล็กตรอนมีประจุไฟฟ้าเท่ากับ 1.60 x 10 -19 คูลอมบ์ และอิเล็กตรอนมีมวลเท่ากับ 9.11 x 10 -28 กรัม
โกลด์สไตน์ ค้นพบ โปรตอน
จากผลการทดลองของทอมสัน โกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้นเขาจึงเสนอแบบจำลองอะตอมว่า
อะตอมมีลักษณะเป็นทรงกลม
อะตอมไม่ใช่สิ่งที่เล็กที่สุด แต่อะตอมจะประกอบด้วยอิเล็กตรอน และอนุภาคอื่นๆอีก
อะตอมประกอบด้วยอนุภาคอิเล็กตรอนที่มีประจุเป็นลบ อนุภาคโปรตอนมีประจุเป็นบวก
อะตอมจะมีโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ
อะตอมเป็นกลางทางไฟฟ้า เพราะ มีจำนวนประจุบวกเท่ากับประจุลบ
จากทฤษฎีอะตอมของทอมสัน แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของทอมสัน
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมจะประกอบด้วยนิวเคลียสที่มีโปรตอนและนิวตรอนรวมตัวกันอยู่อย่างหนาแน่นอยู่ตรงกลางนิวเคลียสมีขนาดเล็กมากมีมวลมาก และมีประจุบวกส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบและมีมวลน้อยมาก จะวิ่งรอบนิวเคลียสเป็นวงกว้าง การค้นพบนิวตรอน เนื่องจากมวลของอะตอมส่วนใหญ่อยู่ที่นิวเคลียสซึ่งเป็นมวลของโปรตอนแต่โปรตอนมีมวลประมาณครึ่งหนึ่งของนิวเคลียสเท่านั้น แสดงว่าต้องมีอนุภาคซึ่งไม่มีประจุไฟฟ้าแต่มีมวลใกล้เคียงกับโปรตอนอยู่ในอะตอมด้วย เจมส์ แชวิก นักวิทยาศาสตร์ชาวอังกฤษ จึงศึกษาทดลองเพิ่มเติมจนพบนิวตรอนซึ่งเป็นกลางทางไฟฟ้า อะตอมของธาตุทุกชนิดในโลกจะมีนิวตรอนเสมอ ยกเว้นอะตอมของไฮโดรเจนในรูปของไอโซโทป
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
จากทฤษฎีอะตอมของ รัทเทอร์ฟอร์ด แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
แบบจำลองอะตอมของนีลส์โบร์
นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,... ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ....
จากทฤษฎีอะตอมของ นีลส์โบร์ แบบจำลองอะตอมมีลักษณะดังรูป
ลักษณะแบบจำลองอะตอมของนีลส์โบร์
เป็นแบบจำลองที่นักวิทยาศาสตร์คิดว่าเป็นไปได้มากที่สุดทั้งนี้ได้จากการประมวลผลการทดลองและข้อมูลต่างๆ อะตอมภายหลังจากที่นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา อาจสรุปได้ดังนี้
1. อิเล็กตรอนไม่สามารถวิ่งรอบนิวเคลียสด้วยรัศมีที่แน่นอน บางครั้งเข้าใกล้บางครั้งออกห่าง จึงไม่สามารถบอกตำแหน่งที่แน่นอนได้ แต่ถ้าบอกได้แต่เพียงที่พบอิเล็กตรอนตำแหน่งต่างๆภายในอะตอมและอิเล็กตรอนที่เคลื่อนที่เร็วมากจนเหมือนกับอิเล็กตรอนอยู่ทั่วไป ในอะตอมลักษณะนี้เรียกว่า " กลุ่มหมอก"
2. กลุ่มหมอกของอิเล็กตรอนในระดับพลังงานต่างๆจะมีรูปทรงต่างกันขึ้นอยู่กับจำนวนอิเล็กตรอน และระดับพลังงานอิเล็กตรอน
3. กลุ่มหมอกที่มีอิเล็กตรอนระดับพลังงานต่ำจะอยู่ใกล้นิวเคลียสส่วนอิเล็กตรอนที่มีระดับพลังงานสูงจะอยู่ไกลนิวเคลียส
4. อิเล็กตรอนแต่ละตัวไม่ได้อยู่ในระดับพลังงานใดพลังงานหนึ่งคงที่
5. อะตอมมีอิเล็กตรอนหลายๆระดับพลังงาน
ลักษณะแบบจำลองอะตอมแบบกลุ่มหมอก
สรุปแบบจำลองอะตอม
อนุภาคมูลฐานของอะตอม
ชนิดของอนุภาคมูลฐานของอะตอม
ทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆ นิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
' อิเล็กตรอน (Electron) สัญลักษณ์ e - มีแระจุลบ และมีมวลน้อยมาก
' โปรตอน สัญลักษณ์ p + มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน ( เกือบ 2,000 เท่า)
' นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆ กับโปรตอน
เลขอะตอม เลขมวล และสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม (atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล (mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
( เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
คำศัพท์ที่ควรทราบ
ไอโซโทป ( Isotope ) หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน เช่น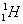
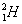

ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน เช่น
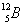
ไอโซโทน ( Isotone ) หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน เช่น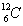
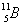
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์
การเขียนสัญลักษณ์นิวเคลียร์
เขียน (A) ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน (Z) ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
ไอโซโทป ( Isotope ) หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน เช่น
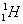
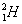

ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน เช่น

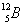
ไอโซโทน ( Isotone ) หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน เช่น
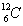
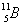
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุลิเทียม ( Li )
สรุปเกี่ยวกับตารางธาตุ แบ่งธาตุในแนวตั้ง (หมู่) แบ่งออกเป็น 18 แถว โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ คือ
– กลุ่ม A มี 8 หมู่ คือ IA ถึง VIIIA
– กลุ่ม B มี 8 หมู่ คือ IB ถึง VIIIB เรียกว่า ธาตุแทรนซิชัน (Transition)
โดย
ธาตุหมู่ที่ IA เรียกว่า “โลหะแอลคาไลน์” ได้แก่ Li Na K Rb Cs และ Fr
ธาตุหมู่ที่ IIA เรียกว่า “ โลหะอัลคาไลน์ เอิร์ท” ได้แก่ Be Mg Ca Sr Ba และ Ra
ธาตุหมู่ที่ VIIA เรียกว่า “ธาตุเฮโลเจน (Halogen)” ได้แก่ F , Cl , Br , I และ At
ธาตุหมู่ที่ VIIIA เรียกว่า “ก๊าซเฉื่อย (Inert gas or Noble gas)” ได้แก่ He , Ne , Ar , Kr , Xe และ Rn
ตารางธาตุในแนวนอนเรียกว่า “คาบ” แบ่งได้ 7 คาบ
คาบที่ 6 แบ่งธาตุเป็น 2 กลุ่ม
– กลุ่มแรกมี 18 ธาตุ คือ Cs ถึง Rn
– กลุ่มที่สองมี 14 ธาตุ คือ Ce ถึง Lu เรียกกลุ่มนี้ว่าLantanides
คาบที่ 7 แบ่งเป็น 2 กลุ่ม
– กลุ่มแรกเริ่มจาก Fr เป็นต้นไปและมีการค้นพบเกิดขึ้นตลอดเวลา
– กลุ่มสองมี 14 ธาตุคือ Th ถึง Lr เรียงกลุ่มนี้ว่า Actinides
“หมู่เดียวกัน จะมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน ซึ่งเท่ากับ เลขประจำหมู่”
“คาบเดียวกัน จะมีจำนวนระดับพลังงานเท่ากัน ซึ่งเท่ากับ เลขที่คาบ”
การตั้งชื่อธาตุที่ค้นพบใหม่ ตั้งตามระบบ IUPAC (InternationalUnion of Pure and Applied Chemistry)
ใช้กับธาตุที่มีเลขอะตอมตั้งแต่ 100 ขึ้นไป
ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็น ภาษาละติน แล้วลงท้ายด้วย– ium
ระบบการนับเลขในภาษาละติน
0 นิล (nil)
1 อูน (un)
2 ไบ (bi)
3 ไตร (tri)
2. รัศมีไอออน
ไอออน คือ อะตอมของธาตุ หรือกลุ่มอะตอมของธาตุที่มีประจุ คือ ไอออนทุกชนิดจะต้องมีจำนวนโปรตอนไม่เท่ากับอิเล็กตรอนถ้าจำนวนโปรตอนมากกว่าอิเล็กตรอนเป็นไอออนบวก และถ้ามีจำนวนโปรตอนน้อยกว่าอิเล็กตรอนเป็นไอออนลบ
การบอกขนาดไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม ซึ่งพิจารณาจากระยะห่างระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
ตัวอย่างรัศมีไอออน
4. อิเล็กโตรเนกาติวิตี (Electronegativity; EN)
ลักษณะทั่วไป
โลหะทั่วไปมีค่า EN ต่ำกว่า จึงเสียอิเล็กตรอนได้ง่ายกว่าเกิดไอออนบวก อโลหะทั่วไปมีค่า EN สูง จึงชิงอิเล็กตรอนได้ดีเกิดไอออนลบ ธาตุเฉื่อยไม่มีค่า EN
ค่า EN ขึ้นอยู่กับ
ก. ขนาดอะตอม หรือจำนวนระดับพลังงาน
ข. ถ้าอะตอมที่มีจำนวนระดับพลังงานเท่ากัน ค่า EN ขึ้นอยู่กับจำนวนโปรตอนในนิวเคลียสเป็นเกณฑ์
5. สัมพรรคภาพอิเล็กตรอน (Electron Affinity; EA)
6. จุดเดือดและจุดหลอมเหลว
แนวโน้มจุดเดือดและจุดหลอมเหลว ตามหมู่
หมู่ IA IIA และ IIIA ลดลงจากบนลงล่าง (ลดตามเลขอะตอมที่เพิ่มขึ้น)
หมู่ VA VIA VIIA และ VIIIA เพิ่มขึ้นจากบนลงล่าง (เพิ่มตามเลขอะตอม)
หมู่ IVA มีแนวโน้มที่ไม่แน่นอน
ตามคาบ
หมู่ IA IIA IIIA และ IVA แนวโน้มสูงขึ้น
หมู่ IVA มีจุดเดือดและจุดหลอมเหลวสูงที่สุด เพราะบางธาตุมีโครงสร้างเป็นผลึกร่างตาข่าย
หมู่ VA VIA VIIA และ VIIIA จุดเดือด จุดหลอมเหลวต่ำ เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีค่าต่ำมาก
7. เลขออกซิเดชัน (Oxidation Number)
เลขออกซิเดชัน คือ เลขที่แสดงถึงค่าประจุไฟฟ้าหรือประจุไฟฟ้าสมมติของไอออนหรืออะตอมของธาตุ
ตัวอย่างเลขออกซิเดชันของธาตุ
โลหะทรานซิชันมีทั้งหมด 40 ตัว จะประกอบด้วยธาตุที่มีเลขอะตอมดังนี้ 21 ถึง 30,39 ถึง 48,71 ถึง 80, และ 103 ถึง 112 ชื่อ "ทรานซิชัน" มาจากตำแหน่งของมันในตารางธาตุทั้ง 4 คาบที่มันอยู่ ธาตุเหล่านี้จะแทนการเพิ่มจำนวนอิเล็กตรอนเข้าไปอยู่ในวงโคจร ดี ของอะตอม (atomic orbital) ด้วยเหตุนี้ โลหะทรานซิชันจึงมีความหมายถึงการส่งผ่าน (transition) ของธาตุหมู่ 2 และหมู่ 13
หมู่3 (III B)4 (IV B)5 (V B)6 (VI B)7 (VII B)8 (VIII B)9 (VIII B)10 (VIII B)11 (I B)12 (II B)
คาบ 4 Sc 21 Ti 22 V 23 Cr 24 Mn 25 Fe 26 Co 27 Ni 28 Cu 29 Zn 30
คาบ 5 Y 39 Zr 40 Nb 41 Mo 42 Tc 43 Ru 44 Rh 45 Pd 46 Ag 47 Cd 48
คาบ 6 Lu 71 Hf 72 Ta 73 W 74 Re 75 Os 76 Ir 77 Pt 78 Au 79 Hg 80
คาบ 7 Lr 103 Rf 104 Db 105 Sg 106 Bh 107 Hs 108 Mt 109 Ds 110 Rg 111 Cn 112
สมบัติของโลหะทรานซิชัน-โลหะทรานซิชันทุกธาตุจะเป็นโลหะ แต่มีความเป็นโลหะน้อยกว่าธาตุหมู่ IA และ IIA
-มีสถานะเป็นของแข็งที่อุณหภูมิห้อง ยกเว้นปรอทที่เป็นของเหลว
-มีจุดหลอมเหลว จุดเดือด และความหนาแน่นสูง
-นำไฟฟ้าได้ดี ซึ่งในโลหะทรานซิชัน ธาตุที่นำไฟฟ้าได้ดีที่สุดคือ เงิน (คาบ 5) และรองลงมาคือ ทอง (คาบ 6)
-นำความร้อนได้ดี
-ธาตุทรานซิชันทั้งหมดมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นธาตุโครเมียม และทองแดง ที่มีเวเลนซ์อิเล็กตรอนเป็น 1
-สารประกอบของธาตุเหล่านี้จะมีสีสัน
-มีพลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมาก
-ขนาดอะตอม จะมีขนาดไม่แตกต่างกันมากโดยที่ในคาบเดียวกันจะเล็กจากซ้ายไปขวา
-ในหมู่เดียวกันจะใหญ่จากบนลงล่าง
-ธาตุเหล่านี้มีหลายออกซิเดชั่นสเตตส์ (oxidation states)
-ธาตุเหล่านี้เป็นตัวเร่งปฏิกิริยา (catalysts) ที่ดี
-ธาตุเหล่านี้มีสีฟ้า-เงินที่อุณหภูมิห้อง (ยกเว้นทองคำและทองแดง)
-สารประกอบของธาตุเหล่านี้สามารถจำแนกโดยการวิเคราะห์ผลึก
ในปี ค.ศ. 1896 อองตวน อองรี เบ็กเคอเรล นักวิทยาศาสตร์ชาวฝรั่งเศส พบว่า เมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม ฟิล์มจะมีลักษณะเหมือนถูกแสง และเมื่อทำการทดลองกับสารประกอบของยูเรเนียมชนิดอื่นๆ ก็ได้ผลเช่นเดียวกัน จึงสรุปได้ว่าน่าจะมีรังสีแผ่ออกมาจากธาตุยูเรเนียม ดังภาพ
ต่อมา ปีแอร์ และมารี กูรี ได้ค้นพบว่า ธาตุยูพอโลเนียม เรเดียม และทอเรียม ก็สามารถแผ่รังสีได้เช่นเดียวกัน เพราะฉะนั้นจึงสรุปได้ว่าภาพที่ 11 การทดลองสารกัมมันตรังสีของอองตวน อองรี เบ็กเคอเรล
ธาตุกัมมันตรังสี หมายถึง ธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82
กัมมันตภาพรังสี หมายถึง ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
ในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่งมีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
(ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา)
-จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า ครึ่งชีวิตของธาตุ
- ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปและสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้
ตารางที่ 7 ชนิดและสมบัติของรังสีบางชนิด
รังสีแอลฟา
หรืออนุภาคแอลฟา
เป็นนิวเคลียสของอะตอมฮีเลียม มีโปรตอนและนิวตรอนอย่างละ 2 อนุภาค มีประจุไฟฟ้า +2 มีเลขมวล 4 มีอำนาจทะลุทะลวงต่ำเพียงแค่กระดาษ อากาศที่หนาประมาณ 2-3 cm น้ำที่หนาขนาดมิลลิเมตร หรือโลหะบางๆ ก็สามารถกั้นอนุภาคแอลฟาได้
รังสีบีตา
หรืออนุภาคบีตา
มีสมบัติเหมือนอิเล็กตรอน มีประจุไฟฟ้า -1 มีมวลเท่ากับอิเล็กตรอน (น้อยมาก) มีอำนาจทะลุทะลวงสูงกว่ารังสีแอลฟาประมาณ 100 เท่า สามารถผ่านแผ่นโลหะบางๆ ได้ และมีความเร็วใกล้เคียงกับความเร็วแสง
รังสีแกมมา
เป็นคลื่อนแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก ไม่มีประจุ ไม่มีมวล เป็นรังสีที่มีพลังงานสูง มีความเร็วเท่ากับความเร็วแสงและมีอำนาจทะลุทะลวงสูง สามารถผ่านแผ่นตะกั่วหนา 8 mm หรือแผ่นคอนกรีตหนาๆ ได้
ภาพที่ 12 อำนาจทะลุทะลวงของรังสีต่างๆ
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ
1. ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า
การเกิดปฏิกิริยาฟิชชัน
2. ปฏิกิริยาฟิวชัน (Fusion reaction) คือ ปฏิกิริยานิวเคลียร์ที่นิวเคลียสของธาตุเบาหลอมรวมกันเข้าเป็นนิวเคลียสที่หนักกว่า และมีการคายความร้อนออกมาจำนวนมหาศาลและมากกว่าปฏิกิริยาฟิชชันเสียอีก ปฏิกิริยาฟิวชันที่รู้จักกันดี คือ ปฏิกิริยาระเบิดไฮโดรเจน (Hydrogen bomb) ดังภาพ
การเกิดปฏิกิริยาฟิวชัน
ประโยชน์จากการใช้ธาตุกัมมันตรังสี
1. ด้านธรณีวิทยา การใช้คาร์บอน-14 (C-14) คำนวณหาอายุของวัตถุโบราณ
2. ด้านการแพทย์ ใช้ไอโอดีน-131 (I-131) ในการติดตามเพื่อศึกษาความผิดปกติของต่อมไธรอยด์ โคบอลต์-60 (Co-60) และเรเดียม-226 (Ra-226) ใช้รักษาโรคมะเร็ง
3. ด้านเกษตรกรรม ใช้ฟอสฟอรัส 32 (P-32) ศึกษาความต้องการปุ๋ยของพืช ปรับปรุงเมล็ดพันธุ์ที่ต้องการ และใช้โพแทสเซียม-32 (K–32) ในการหาอัตราการดูดซึมของต้นไม้
4. ด้านอุตสาหกรรม ใช้ธาตุกัมมันตรังสีตรวจหารอยตำหนิ เช่น รอยร้าวของโลหะหรือท่อขนส่งของเหลว ใช้ธาตุกัมมันตรังสีในการ ตรวจสอบและควบคุมความหนาของวัตถุ ใช้รังสีฉายบนอัญมณีเพื่อให้มีสีสันสวยงาม
5. ด้านการถนอมอาหาร ใช้รังสีแกมมาของธาตุโคบอลต์-60 (Co–60) ปริมาณที่พอเหมาะใช้ทำลายแบคทีเรียในอาหาร จึงช่วยให้เก็บรักษาอาหารไว้ได้นานขึ้น
6. ด้านพลังงาน มีการใช้พลังงานความร้อนที่ได้จากปฏิกิริยานิวเคลียร์ในเตาปฏิกรณ์ปรมาณูของยูเรีเนียม-238 (U-238) ต้มน้ำให้กลายเป็นไอ แล้วผ่านไอน้ำไปหมุนกังหัน เพื่อผลิตกระแสไฟฟ้า

มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
การจัดเรียงอิเล็กตรอน
หลักในการจัดเรียงอิเล็กตรอนในอะตอม
1. อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P < Q
หรือชั้นที่ 1< 2 < 3 < 4 < 5 < 6 < 7
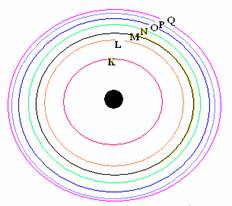
2. ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2 เมื่อ n = เลขชั้น ซึ่งเลขชั้นของชั้น K=1,L=2,M=3,N=4,O=5,P=6 และ Q=7
ตัวอย่าง จำนวน e - ในระดับพลังงานชั้น K มีได้ ไม่เกิน 2n 2 = 2 x 1 2 = 2x1 = 2
จำนวน e - ในระดับพลังงานชั้น N มีได้ ไม่เกิน 2n 2 = 2 x 4 2 = 2x16 = 32
ระดับพลังงาน
จำนวนอิเล็กตรอนที่มีได้มากที่สุด
จะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้ อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f ในแต่ละชั้นย่อย จะมีจำนวน e - ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e - ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e - ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e - ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
วิธีการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอน ให้จัดเรียง e- ในระดับพลังงานชั้นย่อยโดยจัดเรียงลำดับตามลูกศร ( แนวทางการจัดเรียงอิเล็กตรอน ให้เขียนแผนผังก่อน ดังรูป
จัดเรียงอิเล็กตรอนตามลูกศร ดังรูป
ตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม ( Ca )
ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว ( ดูเลขอะตอม จากตารางธาตุ)
แล้วจัดเรียง e- ดังนี้
ดังนั้น การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2
มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (Valence electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป
1.4.1 อนุภาคมูลฐานของอะตอม
อนุภาคมูลฐานของอะตอมทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆนิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
อนุภาค ประจุ(หน่วย) ประจุ(C) มวล(g) มวล(amu)
อิเล็กตรอน -1 1.6 x 10-19 0.000549 9.1096 x 10-28
โปรตรอน +1 1.6 x 10-19 1.007277 1.6726 x 10-24
นิวตรอน 0 0 1.008665 1.6749 x 10-24
อิเล็กตรอน(Electron) สัญลักษณ์ e- มีแระจุลบ และมีมวลน้อยมาก
โปรตอน สัญลักษณ์ p+ มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน (เกือบ 2,000 เท่า)
นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆกับโปรตอน
หมายเหตุ อนุภาคนิวตรอน ค้นพบโดย เจมส์ แซควิก (James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษ(พ.ศ.2475)
เลขอะตอม,เลขมวลและสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม(atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล(mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
(เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน(A)ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน(Z)ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
การจัดเรียงอิเล็กตรอน
หลักในการจัดเรียงอิเล็กตรอนในอะตอม
1. อิเล็กตรอนที่วิ่งอยู่รอบๆ นิวเคลียสนั้น จะอยู่กันเป็นชั้นๆตามระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสที่สุด ( ชั้น K) จะมีพลังงานต่ำที่สุด และอิเล็กตรอนในระดับพลังงานชั้นถัดออกมาจะมีพลังงานสูงขึ้นๆ ตามลำดับ พลังงานของอิเล็กตรอนของระดับชั้นพลังงาน K < L < M < N < O < P < Q
หรือชั้นที่ 1< 2 < 3 < 4 < 5 < 6 < 7

แบบจำลองอะตอมของนีลส์โบร์
2. ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2 เมื่อ n = เลขชั้น ซึ่งเลขชั้นของชั้น K=1,L=2,M=3,N=4,O=5,P=6 และ Q=7
ตัวอย่าง จำนวน e - ในระดับพลังงานชั้น K มีได้ ไม่เกิน 2n 2 = 2 x 1 2 = 2x1 = 2
จำนวน e - ในระดับพลังงานชั้น N มีได้ ไม่เกิน 2n 2 = 2 x 4 2 = 2x16 = 32
ระดับพลังงาน
จำนวนอิเล็กตรอนที่มีได้มากที่สุด
n = 1 (K)
2(1) 2 = 2
n = 2 (L)
2(2) 2 = 8
n = 3 (M)
2(3) 2 = 18
n = 4 (N)
2(4) 2 = 32
n = 5 (O)
2(5) 2 = 32
( 32 คือ เลขมากสุดที่เป็นไปได้ )
n = 6 (P)
2(6) 2 = 32
n = 7 (Q)
2(7) 2 = 32
จะเห็นว่ากฎออกเตตมีข้อด้อย คือ เมื่อระดับพลังงานมากกว่า n = 4 จะใช้ไม่ได้ อย่างไรก็ตามในธาตุ 20 ธาตุแรก สามารถใช้การจัดเรียงอิเล็กตรอนตามกฎออกเตตได้ดี
3. ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f ในแต่ละชั้นย่อย จะมีจำนวน e - ได้ ไม่เกิน ดังนี้
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e - ได้ ไม่เกิน 6 ตัวระดับพลังงานชั้นย่อย d มี e - ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e - ได้ไม่เกิน 14 ตัว เขียนเป็น s 2 p 6 d 10 f 14
วิธีการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอน ให้จัดเรียง e- ในระดับพลังงานชั้นย่อยโดยจัดเรียงลำดับตามลูกศร ( แนวทางการจัดเรียงอิเล็กตรอน ให้เขียนแผนผังก่อน ดังรูป
จัดเรียงอิเล็กตรอนตามลูกศร ดังรูป
ตัวอย่าง จงจัดเรียงอิเล็กตรอนของธาตุ คัลเซียม ( Ca )
ธาตุ Ca มีเลขอะตอม = 20 แสดงว่ามี p = 20 และมี e- = 20 ตัว ( ดูเลขอะตอม จากตารางธาตุ)
แล้วจัดเรียง e- ดังนี้
ดังนั้น การจัดเรียง e- ของธาตุ Ca = 2 , 8 , 8 , 2
มีแผนผังการจัดเรียง e- ดังนี้ Ca มีจำนวน e- ในระดับพลังงานชั้นนอกสุด = 2 ตัว จำนวนอิเล็กตรอนในระดับพลังงานชั้นนอกสุด เรียกว่า เวเลนซ์อิเล็กตรอน (Valence electron) ดังนั้น Ca มีเวเลนซ์อิเล็กตรอน = 2 ดังรูป
1.4.1 อนุภาคมูลฐานของอะตอม
อนุภาคมูลฐานของอะตอมทุกอะตอมประกอบด้วยอนุภาคที่สำคัญคือ โปรตอน, นิวตรอน และอิเล็กตรอน โดยมีโปรตอนกับนิวตรอนอยู่ภายในนิวเคลียส นิวเคลียสนี้จะครอบครองเนื้อที่ภายในอะตอมเพียงเล็กน้อย และมีอิเล็กตรอนวิ่งรอบๆนิวเคลียสด้วยความเร็วสูง คล้ายกับมีกลุ่มประจุลบปกคลุมอยู่โดยรอบ
อนุภาค ประจุ(หน่วย) ประจุ(C) มวล(g) มวล(amu)
อิเล็กตรอน -1 1.6 x 10-19 0.000549 9.1096 x 10-28
โปรตรอน +1 1.6 x 10-19 1.007277 1.6726 x 10-24
นิวตรอน 0 0 1.008665 1.6749 x 10-24
อิเล็กตรอน(Electron) สัญลักษณ์ e- มีแระจุลบ และมีมวลน้อยมาก
โปรตอน สัญลักษณ์ p+ มีประจุเป็นบวก และมีมวลมากกว่า อิเล็กตรอน (เกือบ 2,000 เท่า)
นิวตรอน สัญลักษณ์ n มีประจุเป็นศูนย์ และมีมวลมากพอๆกับโปรตอน
หมายเหตุ อนุภาคนิวตรอน ค้นพบโดย เจมส์ แซควิก (James Chadwick) นักวิทยาศาสตร์ชาวอังกฤษ(พ.ศ.2475)
เลขอะตอม,เลขมวลและสัญลักษณ์นิวเคลียร์
1. จำนวนโปรตอนในนิวเคลียสเรียกว่า เลขอะตอม(atomic number, Z)
2. ผลบวกของจำนวนโปรตอนกับนิวตรอนเรียกว่า เลขมวล(mass number, A)
A = Z + N โดยที่ N เป็นจำนวนนิวตรอน
(เลขเชิงมวลจะเป็นจำนวนเต็มและมีค่าใกล้เคียงกับมวลของอะตอม)
การเขียนสัญลักษณ์นิวเคลียร์
เขียน(A)ไว้ข้างบนด้านซ้ายของสัญลักษณ์ธาตุ
เขียน(Z)ไว้ข้างล่างด้านซ้ายของสัญลักษณ์ธาตุ
X = สัญลักษณ์ของธาตุ
การหาอนุภาคมูลฐานของอะตอม จากสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุลิเทียม ( Li ) มีจำนวนโปรตอน = 3 ตัว อิเล็กตรอน = 3 ตัว และนิวตรอน = 4 ตัว
1.4.2 สัญลักษณ์นิวเคลียร์
สัญลักษณ์นิวเคลียร์ (nuclear symbol) เป็นสัญลักษณ์ที่แสดงจำนวนอนุภาคมูลฐานของอะตอมด้วยเลขมวลและเลขอะตอม เขียนแทนด้วยสัญลักษณ์ดังนี้
โดยที่ X คือ สัญลักษณ์ธาตุ
Z คือ เลขอะตอม (atomic number) เป็นจำนวนโปรตอนในนิวเคลียส
A คือ เลขมวล (mass number) เป็นผลบวกของจำนวนโปรตอนกับนิวตรอน
โดยที่ N เป็นจำนวนนิวตรอน
อะตอมของธาตุเป็นกลางทางไฟฟ้า (จำนวนโปรตอน = จำนวนอิเล็กตรอน)
ตัวอย่างที่ 1 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ภาพที่ 8 การคำนวณหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ ดังนั้น อะตอมของธาตุปรอท (Hg)
มีจำนวนโปรตอน = 80 อนุภาค
อิเล็กตรอน = 80 อนุภาค
และนิวตรอน = 201 - 80 = 121 อนุภาค
ตัวอย่างที่ 2 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ ดังนั้น อะตอมของธาตุแคลเซียม (Ca)
ดังนั้น อะตอมของธาตุลิเทียม ( Li ) มีจำนวนโปรตอน = 3 ตัว อิเล็กตรอน = 3 ตัว และนิวตรอน = 4 ตัว
1.4.2 สัญลักษณ์นิวเคลียร์
สัญลักษณ์นิวเคลียร์ (nuclear symbol) เป็นสัญลักษณ์ที่แสดงจำนวนอนุภาคมูลฐานของอะตอมด้วยเลขมวลและเลขอะตอม เขียนแทนด้วยสัญลักษณ์ดังนี้
โดยที่ X คือ สัญลักษณ์ธาตุ
Z คือ เลขอะตอม (atomic number) เป็นจำนวนโปรตอนในนิวเคลียส
A คือ เลขมวล (mass number) เป็นผลบวกของจำนวนโปรตอนกับนิวตรอน
สูตร A = Z + N
โดยที่ N เป็นจำนวนนิวตรอน
อะตอมของธาตุเป็นกลางทางไฟฟ้า (จำนวนโปรตอน = จำนวนอิเล็กตรอน)
ตัวอย่างที่ 1 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ภาพที่ 8 การคำนวณหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ ดังนั้น อะตอมของธาตุปรอท (Hg)
มีจำนวนโปรตอน = 80 อนุภาค
อิเล็กตรอน = 80 อนุภาค
และนิวตรอน = 201 - 80 = 121 อนุภาค
ตัวอย่างที่ 2 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ ดังนั้น อะตอมของธาตุแคลเซียม (Ca)
มีจำนวนโปรตอน = 20 อนุภาค แคลเซียม +2 หมายถึง มีอิเล็กตรอนน้อยกว่าโปรตอน 2 อนุภาค
อิเล็กตรอน = 20 - 2 = 18 อนุภาค
อิเล็กตรอน = 20 - 2 = 18 อนุภาค
และนิวตรอน = 40 - 20 = 20 อนุภาค
ตัวอย่างที่ 3 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ ดังนั้น อะตอมของธาตุออกซิเจน (O)
มีจำนวนโปรตอน = 8 อนุภาค
ออกซิเจน -2 หมายถึง มีอิเล็กตรอนมากกว่าโปรตอน 2 อนุภาค
อิเล็กตรอน = 8 + 2 = 10 อนุภาค
และนิวตรอน = 16 - 8 = 8 อนุภาค
1.4.3 การจัดเรียงอิเล็กตรอนในอะตอม
ใช้ หลักอาฟบาว (Aufbau principle) ในจัดเรียงอิเล็กตรอนในอะตอม ซึ่งสรุปได้ดังนี้
ใช้หลักของเพาลี ในการบรรจุอิเล็กตรอน คือ ในแต่ละออร์บิทัลจะบรรจุอิเล็กตรอนได้อย่างมากที่สุด 2 ตัว (มีสปินต่างกัน)
ใช้เครื่องหมาย แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
ใช้เครื่องหมาย แทนอิเล็กตรอนที่มีสปินลง (spin down)
แทนอิเล็กตรอนที่มีสปินลง (spin down)
ใช้เครื่องหมาย แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
ใช้เครื่องหมาย แทนอิเล็กตรอนคู่ในออร์บิทัล
แทนอิเล็กตรอนคู่ในออร์บิทัล
บรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานต่ำสุดที่ยังว่างก่อน (เรียงลำดับออร์บิทัลตามลูกศรในรูป) จนครบจำนวนอิเล็กตรอนทั้งหมดในอะตอมนั้น การจัดเรียงอิเล็กตรอนแบบนี้จะทำให้อะตอมมีสถานะเสถียรที่สุดเพราะพลังงานรวมทั้งหมดของอะตอมมีค่าต่ำสุด
การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากันเช่นออร์บิทัล d จะใช้ กฎของฮุนด์ (Hund's rule) คือ"การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน จะบรรจุในลักษณะที่ทำให้มีอิเล็กตรอนเดี่ยวมากที่สุด"
การบรรจุอิเล็กตรอนที่ทุกๆออร์บิทัล มีระดับพลังงานเป็น degenerate (ระดับพลังงานเท่ากัน) ทุกออร์บิทัลอาจมีอิเล็กตรอนอยู่เต็ม (2 อิเล็กตรอนต่อ 1 ออร์บิทัล) หรือมีอิเล็กตรอนอยู่เพียงครึ่งเดียว (1 อิเล็กตรอนต่อ 1 ออร์บิทัล) เช่น
Ne : 1s2, 2s2, 2p6




 เรียกว่า การบรรจุเต็ม
เรียกว่า การบรรจุเต็ม
N : 1s2, 2s2, 2p3




 เรียกว่า การบรรจุครึ่ง
เรียกว่า การบรรจุครึ่ง
โครงแบบอิเล็กตรอนแบบบรรจุเต็มจะเสถียรกว่าแบบบรรจุครึ่งและแบบบรรจุครึ่งก็จะเสถียรกว่าแบบอื่นๆ
เช่น
2p6เสถียรกว่า 2p3
2p3เสถียรกว่า 2p4
3d10เสถียรกว่า 3d9
ตัวอย่าง ใช้หลักเอาฟบาวเขียนโครงแบบอิเล็กตรอน สำหรับ15p
วิธีทำ บรรจุอิเล็กตรอนในออร์บิทัลต่างๆ ตามระดับพลังงานดังนี้
3s


 2p
2p
2s
1s
จากแผนภาพข้างต้นนำมาเขียนโครงแบบอิเล็กตรอนตามระดับพลังงานในออร์บิทัลที่เพิ่มขึ้นได้เป็นดังนี้
1s2 2s2 2p6 3s2 3p3
และทำนองเดียวกันเขียนโครงแบบอิเล็กตรอนใน 18Ar และ 19K ได้ดังนี้
18Ar 1s2 2s2 2p6 3s2 3p6
19K 1s2 2s2 2p6 3s2 3p64s1
การเขียนโครงแบบอิเล็กตรอนอาจเขียนย่อให้สั้นลง โดยแยกส่วนที่เป็นโครงแบบของแก๊สมีสกุล (nobel gas) ไว้ในวงเล็บ ดังนี้
19K [Ar] 4s 1
ตัวอย่าง เขียนโครงแบบอิเล็กตรอนของ 24Cr
1s2 2s2 2p6 3s2 3p64s13d5
หรือเขียนเป็น
1s2 2s2 2p6 3s2 3p63d54s1
สำหรับ29Cu ก็จะมีโครงแบบอิเล็กตรอนเป็น
1s2 2s2 2p6 3s2 3p63d104s1
หรือเขียนเป็น
1s2 2s2 2p6 3s2 3p63d94s2
ทั้งนี้เนื่องจากการจัดเป็น filled configuration จะเสถียรกว่า
ตารางแสดงโครงแบบอิเล็กตรอนของธาตุ
เลขอะตอมมิก ธาตุ โครงแบบอิเล็กตรอน
1H1s1
2[He]1s2
3Li[He] 2s1
4Be[He] 2s2
5B[He] 2s2 2p1
6C[He] 2s2 2p2
7N[He] 2s2 2p3
8O[He] 2s2 2p4
9F[He] 2s2 2p5
10Ne[He] 2s2 2p6
11Na[Ne] 3s1
12Mg[Ne] 3s2
13Al[Ne] 3s23p1
14Si[Ne] 3s2 3p2
การเสียอิเล็กตรอนทำให้อิเล็กตรอนเปลี่ยนไปเป็นไอออนบวก อิเล็กตรอนจะหลุดจากระดับย่อยที่มีพลังงานสูงสุดของระดับซึ่งมีค่า n เป็นค่าสุงสุดของอะตอมนั้น เช่น 33As มีโครงแบบอิเล็กตรอนเป็น
1s2 2s2 2p6 3s23p63d104s24p3
เมื่อเสียอิเล็กตรอนไป 3 ตัว จะเป็น As3+ อิเล็กตรอนทั้ง 3 ตัว ใน 4p จะหลุดออกไปเหลือโครงแบบอิเล็กตรอนของ As3+ เป็น
1s2 2s2 2p6 3s23p63d104s2
ตารางธาตุ ก่อนจะเป็นตารางธาตุ
หลักการนี้ใช้ไม่ได้กับธาตุบางชนิด ชุดสามของกลุ่มธาตุบางชนิด ธาตุตรงกลาง มีมวลอะตอมไม่เท่ากับค่าเฉลี่ยของธาตุที่เหลือทั้ง 2
ตัวอย่างที่ 3 การหาอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์ ดังนั้น อะตอมของธาตุออกซิเจน (O)
มีจำนวนโปรตอน = 8 อนุภาค
ออกซิเจน -2 หมายถึง มีอิเล็กตรอนมากกว่าโปรตอน 2 อนุภาค
อิเล็กตรอน = 8 + 2 = 10 อนุภาค
และนิวตรอน = 16 - 8 = 8 อนุภาค
1.4.3 การจัดเรียงอิเล็กตรอนในอะตอม
ใช้ หลักอาฟบาว (Aufbau principle) ในจัดเรียงอิเล็กตรอนในอะตอม ซึ่งสรุปได้ดังนี้
ใช้หลักของเพาลี ในการบรรจุอิเล็กตรอน คือ ในแต่ละออร์บิทัลจะบรรจุอิเล็กตรอนได้อย่างมากที่สุด 2 ตัว (มีสปินต่างกัน)
ใช้เครื่องหมาย
 แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)
แทนอิเล็กตรอนที่มีสปินขึ้น (spin up)ใช้เครื่องหมาย
 แทนอิเล็กตรอนที่มีสปินลง (spin down)
แทนอิเล็กตรอนที่มีสปินลง (spin down)ใช้เครื่องหมาย
 แทนอิเล็กตรอนเดี่ยวในออร์บิทัล
แทนอิเล็กตรอนเดี่ยวในออร์บิทัลใช้เครื่องหมาย
 แทนอิเล็กตรอนคู่ในออร์บิทัล
แทนอิเล็กตรอนคู่ในออร์บิทัลบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานต่ำสุดที่ยังว่างก่อน (เรียงลำดับออร์บิทัลตามลูกศรในรูป) จนครบจำนวนอิเล็กตรอนทั้งหมดในอะตอมนั้น การจัดเรียงอิเล็กตรอนแบบนี้จะทำให้อะตอมมีสถานะเสถียรที่สุดเพราะพลังงานรวมทั้งหมดของอะตอมมีค่าต่ำสุด
การบรรจุอิเล็กตรอนที่ทุกๆออร์บิทัล มีระดับพลังงานเป็น degenerate (ระดับพลังงานเท่ากัน) ทุกออร์บิทัลอาจมีอิเล็กตรอนอยู่เต็ม (2 อิเล็กตรอนต่อ 1 ออร์บิทัล) หรือมีอิเล็กตรอนอยู่เพียงครึ่งเดียว (1 อิเล็กตรอนต่อ 1 ออร์บิทัล) เช่น
Ne : 1s2, 2s2, 2p6




 เรียกว่า การบรรจุเต็ม
เรียกว่า การบรรจุเต็มN : 1s2, 2s2, 2p3




 เรียกว่า การบรรจุครึ่ง
เรียกว่า การบรรจุครึ่งโครงแบบอิเล็กตรอนแบบบรรจุเต็มจะเสถียรกว่าแบบบรรจุครึ่งและแบบบรรจุครึ่งก็จะเสถียรกว่าแบบอื่นๆ
เช่น
2p6เสถียรกว่า 2p3
2p3เสถียรกว่า 2p4
3d10เสถียรกว่า 3d9
ตัวอย่าง ใช้หลักเอาฟบาวเขียนโครงแบบอิเล็กตรอน สำหรับ15p
วิธีทำ บรรจุอิเล็กตรอนในออร์บิทัลต่างๆ ตามระดับพลังงานดังนี้
3s



 2p
2p2s

1s

จากแผนภาพข้างต้นนำมาเขียนโครงแบบอิเล็กตรอนตามระดับพลังงานในออร์บิทัลที่เพิ่มขึ้นได้เป็นดังนี้
1s2 2s2 2p6 3s2 3p3
และทำนองเดียวกันเขียนโครงแบบอิเล็กตรอนใน 18Ar และ 19K ได้ดังนี้
18Ar 1s2 2s2 2p6 3s2 3p6
19K 1s2 2s2 2p6 3s2 3p64s1
การเขียนโครงแบบอิเล็กตรอนอาจเขียนย่อให้สั้นลง โดยแยกส่วนที่เป็นโครงแบบของแก๊สมีสกุล (nobel gas) ไว้ในวงเล็บ ดังนี้
19K [Ar] 4s 1
ตัวอย่าง เขียนโครงแบบอิเล็กตรอนของ 24Cr
1s2 2s2 2p6 3s2 3p64s13d5
หรือเขียนเป็น
1s2 2s2 2p6 3s2 3p63d54s1
สำหรับ29Cu ก็จะมีโครงแบบอิเล็กตรอนเป็น
1s2 2s2 2p6 3s2 3p63d104s1
หรือเขียนเป็น
1s2 2s2 2p6 3s2 3p63d94s2
ทั้งนี้เนื่องจากการจัดเป็น filled configuration จะเสถียรกว่า
ตารางแสดงโครงแบบอิเล็กตรอนของธาตุ
เลขอะตอมมิก ธาตุ โครงแบบอิเล็กตรอน
1H1s1
2[He]1s2
3Li[He] 2s1
4Be[He] 2s2
5B[He] 2s2 2p1
6C[He] 2s2 2p2
7N[He] 2s2 2p3
8O[He] 2s2 2p4
9F[He] 2s2 2p5
10Ne[He] 2s2 2p6
11Na[Ne] 3s1
12Mg[Ne] 3s2
13Al[Ne] 3s23p1
14Si[Ne] 3s2 3p2
การเสียอิเล็กตรอนทำให้อิเล็กตรอนเปลี่ยนไปเป็นไอออนบวก อิเล็กตรอนจะหลุดจากระดับย่อยที่มีพลังงานสูงสุดของระดับซึ่งมีค่า n เป็นค่าสุงสุดของอะตอมนั้น เช่น 33As มีโครงแบบอิเล็กตรอนเป็น
1s2 2s2 2p6 3s23p63d104s24p3
เมื่อเสียอิเล็กตรอนไป 3 ตัว จะเป็น As3+ อิเล็กตรอนทั้ง 3 ตัว ใน 4p จะหลุดออกไปเหลือโครงแบบอิเล็กตรอนของ As3+ เป็น
1s2 2s2 2p6 3s23p63d104s2
ตารางธาตุ ก่อนจะเป็นตารางธาตุ
ปี พ.ศ. 2360 โยฮันน์ เดอเบอไรเนอร์ เป็นนักเคมีคนแรกที่พยายามจัดธาตุเป็นกลุ่มๆ ละ 3 ธาตุ ตามสมบัติที่คล้ายคลึงกันเรียกว่า “ชุดสาม” โดยพบว่าธาตุกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีกสองธาตุที่เหลือ เช่น Na เป็นธาตุกลางระหว่าง Li กับ K มีมวลอะตอม 23 ซึ่งเป็นค่าเฉลี่ยนของมวลอะตอมของธาตุ Li ซึ่งมีมวล 7 กับธาตุ K ซึ่งมีมวลอะตอม 39 ดังรูป
ปี พ.ศ. 2407 จอห์น นิวแลนด์ ได้เสนอกฎในการจัดเรียงธาตุเป็นหมวดหมู่ว่า “ถ้าเรียงธาตุตามมวลอะตอมจากน้อยไปหามากพบว่าธาตุที่ 8 จะมีสมบัติเหมือนกับธาตุที่ 1 เสมอ” (ไม่รวมธาตุไฮโดรเจนและ
สมบัติเหมือนกับธาตุที่ 1 เสมอ ปี พ.ศ. 2412 ยูลิอุสโลทาร์ ไมเออร์ และ ดิมิทรี อิวา–โนวิช เมนเดเลเอฟ ได้จัดธาตุโดยเรียงตามมวลอะตอมจากน้อยไปมากโดยพบว่าธาตุมีสมบัติคล้ายกันเป็นช่วงๆ เมนเดเลเอฟจึงตั้งกฎที่เรียกว่า กฏพิริออดิก และเรียกตารางธาตุว่า ตารางพิริออดิกของเมนเดเลเอฟ
ตารางธาตุของเมนเดเลเอฟ
ต่อมา เฮนรี โมสลีย์ ได้เสนอให้จัดเรียงธาตุตามเลขอะตอม เนื่องจากสมบัติต่างๆ ของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ดังนั้น ตารางธาตุปัจจุบันจึงจัดเรียงตามเลขอะตอมจากน้อยไปมาก
ตารางธาตุปัจจุบัน เรียงตามเลขออะตอมจากน้อยไปมาก
สรุปเกี่ยวกับตารางธาตุ แบ่งธาตุในแนวตั้ง (หมู่) แบ่งออกเป็น 18 แถว โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ คือ
– กลุ่ม A มี 8 หมู่ คือ IA ถึง VIIIA
– กลุ่ม B มี 8 หมู่ คือ IB ถึง VIIIB เรียกว่า ธาตุแทรนซิชัน (Transition)
โดย
ธาตุหมู่ที่ IA เรียกว่า “โลหะแอลคาไลน์” ได้แก่ Li Na K Rb Cs และ Fr
ธาตุหมู่ที่ IIA เรียกว่า “ โลหะอัลคาไลน์ เอิร์ท” ได้แก่ Be Mg Ca Sr Ba และ Ra
ธาตุหมู่ที่ VIIA เรียกว่า “ธาตุเฮโลเจน (Halogen)” ได้แก่ F , Cl , Br , I และ At
ธาตุหมู่ที่ VIIIA เรียกว่า “ก๊าซเฉื่อย (Inert gas or Noble gas)” ได้แก่ He , Ne , Ar , Kr , Xe และ Rn
ตารางธาตุในแนวนอนเรียกว่า “คาบ” แบ่งได้ 7 คาบ
คาบที่ 6 แบ่งธาตุเป็น 2 กลุ่ม
– กลุ่มแรกมี 18 ธาตุ คือ Cs ถึง Rn
– กลุ่มที่สองมี 14 ธาตุ คือ Ce ถึง Lu เรียกกลุ่มนี้ว่าLantanides
คาบที่ 7 แบ่งเป็น 2 กลุ่ม
– กลุ่มแรกเริ่มจาก Fr เป็นต้นไปและมีการค้นพบเกิดขึ้นตลอดเวลา
– กลุ่มสองมี 14 ธาตุคือ Th ถึง Lr เรียงกลุ่มนี้ว่า Actinides
“หมู่เดียวกัน จะมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน ซึ่งเท่ากับ เลขประจำหมู่”
“คาบเดียวกัน จะมีจำนวนระดับพลังงานเท่ากัน ซึ่งเท่ากับ เลขที่คาบ”
กลุ่ม s, p, d และ f-block สามารถจัดกลุ่มได้ดังรูป
ธาตุในกลุ่ม s, p, d, และ f-block
การตั้งชื่อธาตุที่ค้นพบใหม่ ตั้งตามระบบ IUPAC (InternationalUnion of Pure and Applied Chemistry)
ใช้กับธาตุที่มีเลขอะตอมตั้งแต่ 100 ขึ้นไป
ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็น ภาษาละติน แล้วลงท้ายด้วย– ium
ระบบการนับเลขในภาษาละติน
0 นิล (nil)
1 อูน (un)
2 ไบ (bi)
3 ไตร (tri)
4 ควอด (quad)
5 เพนท์ (pent)
6 เฮกซ์ (hex)
7 เซปท์ (sept)
8 ออกต์(oct)
9 เอนน์ (enn)
ตัวอย่างการเรียกชื่อธาตุที่ 104 ตามระบบ IUPAC อ่านว่า
Unn+nil+quad+ium = Unnilquadium
ธาตุที่ 105 อ่านว่า
Unn+nil+pent+ium = Unnilpentium
Unn+nil+quad+ium = Unnilquadium
ธาตุที่ 105 อ่านว่า
Unn+nil+pent+ium = Unnilpentium
ส่วนที่ 2 สมบัติของธาตุตามหมู่และตามคาบ
1. ขนาดอะตอม
การบอกขนาดอะตอมจะบอกโดยใช้รัศมีอะตอม ซึ่งมีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน รัศมีอะตอมมีหลายแบบ ขึ้นอยู่กับชนิดของแรงที่ยึดเหนี่ยวระหว่างอะตอม
– รัศมีโคเวเลนต์ คือ ระยะทางครึ่งหนึ่งของความยาวพันธะโคเวเลนต์ระหว่างอะตอมชนิดเดียวกัน
ตัวอย่างรัศมีโคเวเลนต์
– รัศมีแวนเดอร์วาลล์ คือระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมที่อยู่ใกล้ที่สุด
ตัวอย่างรัศมีแวนเดอร์วาลล์
แนวโน้มขนาดอะตอมในตารางธาตุ
1. ขนาดอะตอม
การบอกขนาดอะตอมจะบอกโดยใช้รัศมีอะตอม ซึ่งมีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน รัศมีอะตอมมีหลายแบบ ขึ้นอยู่กับชนิดของแรงที่ยึดเหนี่ยวระหว่างอะตอม
– รัศมีโคเวเลนต์ คือ ระยะทางครึ่งหนึ่งของความยาวพันธะโคเวเลนต์ระหว่างอะตอมชนิดเดียวกัน
– รัศมีแวนเดอร์วาลล์ คือระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมที่อยู่ใกล้ที่สุด
– รัศมีโลหะ คือ ระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมโลหะที่อยู่ใกล้กันมากที่สุด
ตัวอย่างรัศมีโลหะ
แนวโน้มขนาดอะตอมในตารางธาตุ
ไอออน คือ อะตอมของธาตุ หรือกลุ่มอะตอมของธาตุที่มีประจุ คือ ไอออนทุกชนิดจะต้องมีจำนวนโปรตอนไม่เท่ากับอิเล็กตรอนถ้าจำนวนโปรตอนมากกว่าอิเล็กตรอนเป็นไอออนบวก และถ้ามีจำนวนโปรตอนน้อยกว่าอิเล็กตรอนเป็นไอออนลบ
การบอกขนาดไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม ซึ่งพิจารณาจากระยะห่างระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
ตัวอย่างรัศมีไอออน
แนวโน้มของขนาดไอออนในตารางธาตุ
3. พลังงานไออนไนเซชัน (Ionization Energy; IE)
คือ พลังงานจำนวนน้อยที่สุดที่ใช้ดึงอิเล็กตรอนออกจากอะตอมของธาตุที่เป็นแก๊สครั้งละ 1 อิเล็กตรอนทำให้กลายเป็นไอออนบวกที่เป็นแก๊ส
สามารถเขียนสมการได้ดังนี้
X(g) + IE —-> X+ (g) + e–
ตัวอย่าง ค่า IE1 ถึง IE3 ของ Li
Li(g) → Li+(g) + e– IE1 = 520 kJ/mol
Li+(g) → Li2+(g) + e– IE2 = 7,394 kJ/mol
Li2+(g) → Li3+(g) + e– IE3 = 11,815 kJ/mol
ตัวอย่างกราฟไอออนไนเซชัน
คือ พลังงานจำนวนน้อยที่สุดที่ใช้ดึงอิเล็กตรอนออกจากอะตอมของธาตุที่เป็นแก๊สครั้งละ 1 อิเล็กตรอนทำให้กลายเป็นไอออนบวกที่เป็นแก๊ส
สามารถเขียนสมการได้ดังนี้
X(g) + IE —-> X+ (g) + e–
ตัวอย่าง ค่า IE1 ถึง IE3 ของ Li
Li(g) → Li+(g) + e– IE1 = 520 kJ/mol
Li+(g) → Li2+(g) + e– IE2 = 7,394 kJ/mol
Li2+(g) → Li3+(g) + e– IE3 = 11,815 kJ/mol
ตัวอย่างกราฟไอออนไนเซชัน
แนวโน้มค่า IE ในตารางธาต
4. อิเล็กโตรเนกาติวิตี (Electronegativity; EN)
คือ ค่าที่แสดงความสามารถในการดึงอิเล็กตรอนเข้าหาตัวเองของอะตอมของธาตุ ในพันธะเคมีหนึ่ง อะตอมที่มีค่า EN สูงจะดึงดูดอิเล็กตรอนได้ดีกว่าอะตอมที่มี EN ต่ำ
แนวโน้มค่า EN ในตารางธาตุ
ลักษณะทั่วไป
โลหะทั่วไปมีค่า EN ต่ำกว่า จึงเสียอิเล็กตรอนได้ง่ายกว่าเกิดไอออนบวก อโลหะทั่วไปมีค่า EN สูง จึงชิงอิเล็กตรอนได้ดีเกิดไอออนลบ ธาตุเฉื่อยไม่มีค่า EN
ค่า EN ขึ้นอยู่กับ
ก. ขนาดอะตอม หรือจำนวนระดับพลังงาน
ข. ถ้าอะตอมที่มีจำนวนระดับพลังงานเท่ากัน ค่า EN ขึ้นอยู่กับจำนวนโปรตอนในนิวเคลียสเป็นเกณฑ์
สัมพรรคภาพอิเล็กตรอน คือ พลังงาน ที่อะตอมในสถานะแก๊ส คายออกมา เมื่อได้ รับอิเล็กตรอน
แนวโน้มค่า EA
แนวโน้มจุดเดือดและจุดหลอมเหลว ตามหมู่
หมู่ IA IIA และ IIIA ลดลงจากบนลงล่าง (ลดตามเลขอะตอมที่เพิ่มขึ้น)
หมู่ VA VIA VIIA และ VIIIA เพิ่มขึ้นจากบนลงล่าง (เพิ่มตามเลขอะตอม)
หมู่ IVA มีแนวโน้มที่ไม่แน่นอน
ตามคาบ
หมู่ IA IIA IIIA และ IVA แนวโน้มสูงขึ้น
หมู่ IVA มีจุดเดือดและจุดหลอมเหลวสูงที่สุด เพราะบางธาตุมีโครงสร้างเป็นผลึกร่างตาข่าย
หมู่ VA VIA VIIA และ VIIIA จุดเดือด จุดหลอมเหลวต่ำ เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีค่าต่ำมาก
7. เลขออกซิเดชัน (Oxidation Number)
เลขออกซิเดชัน คือ เลขที่แสดงถึงค่าประจุไฟฟ้าหรือประจุไฟฟ้าสมมติของไอออนหรืออะตอมของธาตุ
ธาตุแต่ละชนิดมีเลขออกซิเดชันเป็นเท่าไหร่ให้เป็นไปตามเกณฑ์ดังนี้
หมู่3 (III B)4 (IV B)5 (V B)6 (VI B)7 (VII B)8 (VIII B)9 (VIII B)10 (VIII B)11 (I B)12 (II B)
คาบ 4 Sc 21 Ti 22 V 23 Cr 24 Mn 25 Fe 26 Co 27 Ni 28 Cu 29 Zn 30
คาบ 5 Y 39 Zr 40 Nb 41 Mo 42 Tc 43 Ru 44 Rh 45 Pd 46 Ag 47 Cd 48
คาบ 6 Lu 71 Hf 72 Ta 73 W 74 Re 75 Os 76 Ir 77 Pt 78 Au 79 Hg 80
คาบ 7 Lr 103 Rf 104 Db 105 Sg 106 Bh 107 Hs 108 Mt 109 Ds 110 Rg 111 Cn 112
สมบัติของโลหะทรานซิชัน-โลหะทรานซิชันทุกธาตุจะเป็นโลหะ แต่มีความเป็นโลหะน้อยกว่าธาตุหมู่ IA และ IIA
-มีสถานะเป็นของแข็งที่อุณหภูมิห้อง ยกเว้นปรอทที่เป็นของเหลว
-มีจุดหลอมเหลว จุดเดือด และความหนาแน่นสูง
-นำไฟฟ้าได้ดี ซึ่งในโลหะทรานซิชัน ธาตุที่นำไฟฟ้าได้ดีที่สุดคือ เงิน (คาบ 5) และรองลงมาคือ ทอง (คาบ 6)
-นำความร้อนได้ดี
-ธาตุทรานซิชันทั้งหมดมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นธาตุโครเมียม และทองแดง ที่มีเวเลนซ์อิเล็กตรอนเป็น 1
-สารประกอบของธาตุเหล่านี้จะมีสีสัน
-มีพลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมาก
-ขนาดอะตอม จะมีขนาดไม่แตกต่างกันมากโดยที่ในคาบเดียวกันจะเล็กจากซ้ายไปขวา
-ในหมู่เดียวกันจะใหญ่จากบนลงล่าง
-ธาตุเหล่านี้มีหลายออกซิเดชั่นสเตตส์ (oxidation states)
-ธาตุเหล่านี้เป็นตัวเร่งปฏิกิริยา (catalysts) ที่ดี
-ธาตุเหล่านี้มีสีฟ้า-เงินที่อุณหภูมิห้อง (ยกเว้นทองคำและทองแดง)
-สารประกอบของธาตุเหล่านี้สามารถจำแนกโดยการวิเคราะห์ผลึก
ธาตุกัมมันตรังสี
ในปี ค.ศ. 1896 อองตวน อองรี เบ็กเคอเรล นักวิทยาศาสตร์ชาวฝรั่งเศส พบว่า เมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม ฟิล์มจะมีลักษณะเหมือนถูกแสง และเมื่อทำการทดลองกับสารประกอบของยูเรเนียมชนิดอื่นๆ ก็ได้ผลเช่นเดียวกัน จึงสรุปได้ว่าน่าจะมีรังสีแผ่ออกมาจากธาตุยูเรเนียม ดังภาพ
ต่อมา ปีแอร์ และมารี กูรี ได้ค้นพบว่า ธาตุยูพอโลเนียม เรเดียม และทอเรียม ก็สามารถแผ่รังสีได้เช่นเดียวกัน เพราะฉะนั้นจึงสรุปได้ว่าภาพที่ 11 การทดลองสารกัมมันตรังสีของอองตวน อองรี เบ็กเคอเรล
ธาตุกัมมันตรังสี หมายถึง ธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82
กัมมันตภาพรังสี หมายถึง ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
ในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่งมีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
-จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า ครึ่งชีวิตของธาตุ
- ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปและสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้
ตารางที่ 7 ชนิดและสมบัติของรังสีบางชนิด
รังสีแอลฟา
หรืออนุภาคแอลฟา
เป็นนิวเคลียสของอะตอมฮีเลียม มีโปรตอนและนิวตรอนอย่างละ 2 อนุภาค มีประจุไฟฟ้า +2 มีเลขมวล 4 มีอำนาจทะลุทะลวงต่ำเพียงแค่กระดาษ อากาศที่หนาประมาณ 2-3 cm น้ำที่หนาขนาดมิลลิเมตร หรือโลหะบางๆ ก็สามารถกั้นอนุภาคแอลฟาได้
รังสีบีตา
หรืออนุภาคบีตา
มีสมบัติเหมือนอิเล็กตรอน มีประจุไฟฟ้า -1 มีมวลเท่ากับอิเล็กตรอน (น้อยมาก) มีอำนาจทะลุทะลวงสูงกว่ารังสีแอลฟาประมาณ 100 เท่า สามารถผ่านแผ่นโลหะบางๆ ได้ และมีความเร็วใกล้เคียงกับความเร็วแสง
รังสีแกมมา
ภาพที่ 12 อำนาจทะลุทะลวงของรังสีต่างๆ
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ
1. ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า
ประโยชน์จากการใช้ธาตุกัมมันตรังสี
1. ด้านธรณีวิทยา การใช้คาร์บอน-14 (C-14) คำนวณหาอายุของวัตถุโบราณ
2. ด้านการแพทย์ ใช้ไอโอดีน-131 (I-131) ในการติดตามเพื่อศึกษาความผิดปกติของต่อมไธรอยด์ โคบอลต์-60 (Co-60) และเรเดียม-226 (Ra-226) ใช้รักษาโรคมะเร็ง
3. ด้านเกษตรกรรม ใช้ฟอสฟอรัส 32 (P-32) ศึกษาความต้องการปุ๋ยของพืช ปรับปรุงเมล็ดพันธุ์ที่ต้องการ และใช้โพแทสเซียม-32 (K–32) ในการหาอัตราการดูดซึมของต้นไม้
4. ด้านอุตสาหกรรม ใช้ธาตุกัมมันตรังสีตรวจหารอยตำหนิ เช่น รอยร้าวของโลหะหรือท่อขนส่งของเหลว ใช้ธาตุกัมมันตรังสีในการ ตรวจสอบและควบคุมความหนาของวัตถุ ใช้รังสีฉายบนอัญมณีเพื่อให้มีสีสันสวยงาม
5. ด้านการถนอมอาหาร ใช้รังสีแกมมาของธาตุโคบอลต์-60 (Co–60) ปริมาณที่พอเหมาะใช้ทำลายแบคทีเรียในอาหาร จึงช่วยให้เก็บรักษาอาหารไว้ได้นานขึ้น
6. ด้านพลังงาน มีการใช้พลังงานความร้อนที่ได้จากปฏิกิริยานิวเคลียร์ในเตาปฏิกรณ์ปรมาณูของยูเรีเนียม-238 (U-238) ต้มน้ำให้กลายเป็นไอ แล้วผ่านไอน้ำไปหมุนกังหัน เพื่อผลิตกระแสไฟฟ้า
เอ็กซ์-เรย์ อาบรังสีเพื่อถนอมอาหาร โรงงานไฟฟ้านิวเคลียร์

ตัวอย่างประโยชน์จากธาตุกัมมันตรังสี













































ไม่มีความคิดเห็น:
แสดงความคิดเห็น